卖不好药的君实生物又要上市了(这次是去瑞士)
VV116虽然在国产新冠口服药第一梯队中获批上岸,但商业化前景同样不算乐观。今年3月31日,VV116降价进入A类新冠治疗药品分类,参考采购价每疗程630元/盒。此前披露的君实生物5月调研活动记录显示,2023年第一季度,VV116销售收入为1149.50万元。以此推算,一季度VV116116大约售出1.8万盒。
界面新闻编辑 | 谢欣
除了前述三个产品,君实生物还有一个商业化产品为阿达木单抗生物类似药。该药于2022年3月获批,上市之时已是国内第7款、国产第6款同类产品,商业化难度和市场空间可见一斑。
但好景不长,由于对新变异毒株无效,该双抗疗法在2021年6月被FDA叫停使用。此外,2021年内,这一海外授权也已达成所有约定的里程碑事件。也就是说,未来埃特司韦单抗起码在新冠上对君实的营收贡献已经非常有限。
但落回业绩表现,即使有数款商业化产品在手,君实生物至今仍未盈利。2022年,公司营收14.53亿元,不及2020年水平,归母净利润亏损23.88亿元,几乎是2020年和2021年归母净利润亏损水平之和。
这样情况在2022年仅算是略有好转,其销售收入为7.36亿元,同比增长78.77%。同期,信迪利单抗、替雷利珠单抗的销售额则分别约20亿元、30亿元。
而根据此前君实生物披露,VV116的直接研发费用8.80亿元,每盒原料药成本385.01元。粗略估计,降价后,若要覆盖直接研发费用,需要售出360万盒。一季度的销售数量在这一数据前几乎是杯水车薪。
特瑞普利单抗被认为是“起个大早,赶个晚集”的例子。其于2018年率先获批,本应具有先发优势,但在进入医保的时间点上被后来者信迪利单抗反超。后者在2019年进入国家医保,前者则等到2020年与同类产品替雷利珠单抗、恒瑞医药的卡瑞利珠单抗“同台竞技”。
此外,君实生物的另一核心在研产品是BTLA单抗(TAB004/JS004)。其用于治疗黑色素瘤、肺癌、淋巴瘤等,是全球首个获批临床试验的BTLA单抗。据公司2022年年报,该产品正在中美两地开展多项Ib/II期临床试验。也就是说,其仍存在研发风险,且离商业变现也还需时日。
伴随公司商业化团队动荡,商业化负责人和内部营销人员轮番调整,该产品2021年的销售额仅有4.12亿元。与之对比的是,同年,百济神州PD-1替雷利珠单抗销售额16亿元,信达生物PD-1信迪利单抗销售额近30亿元。
而在君实生物剩下管线中,进展最快的是昂戈瑞西单抗、贝伐珠单抗和PARP抑制剂,均处于临床三期阶段。这其中,后两者在国内已有数个同类产品获批,且进入医保。
就在本次谋求在瑞士证交所上市的约半年前,君实生物刚刚完成一轮约37.8亿元的A股定增。再往前看,君实生物2018年在港交所上市,2020年登陆科创板,分别募资29.44亿港元、48.36亿元。
研发管线多、投入大,却难寻下一个蓝海市场和重磅产品。新的利润增长点和自身造血能力是君实生物目前最迫切要解决的问题。
6月6日,君实生物发布2023年度境外发行GDR新增境内基础股份的发行预案。根据本次预案,君实生物本次发行的GDR,以公司新增发的A股股票作为基础证券,并在瑞士证券交易所挂牌上市,募集资金为美元,募资总额(含发行费用)按照定价基准日的人民币对美元汇率中间价折算后不超人民币34亿元。
2021年2月,埃特司韦单抗和巴尼韦单抗联合疗法获得FDA的紧急使用授权(EUA),用于治疗12岁及以上具有进展至重度或住院高风险的轻、中度新冠患者,随后又两次扩大适用范围。在这一因素下,君实生物还在2021年上半年首次扭亏,获得归母净利润934.70万元。
在刚刚过去的新冠疫情中,君实生物共有两款产品获批,分别是中和抗体埃特司韦单抗,以及小分子口服药VV116(商品名:民得维)。2020年5月,君实生物将前者的海外权益授权给礼来。为此,公司获得1000万美元首付款,及最高可达2.45亿美元的里程碑付款,外加销售分成。
6月6日开盘,君实生物股价震荡下跌,A股收盘价40.54元/股,跌幅5.01%;H股收盘价23.950港元/股,跌幅5.34%。
丁香园insight数据库显示,目前,在这一靶点上,国内仅有赛诺菲/再生元的阿利西尤单抗(alirocumab)和安进的依洛尤单抗(alirocumab)两个进口产品获批。此外,康方生物、信达生物、诺华和君实生物的产品均处于上市申请阶段,恒瑞、辉瑞则有产品处于临床三期阶段。换而言之,君实也面临着不小竞争。
君实生物成立于2012年,是国内biotech(生物科技公司,更强调研发能力)的代表。其众多管线和创新技术平台的布局也被看作是国内biotech有着biopharma(生物制药公司,既注重研发,也有生产和商业化能力)梦想的典型。但到目前为止,君实生物身上贴着三个标签,分别是“卷无可卷”的PD-1,已经过去的新冠,以及不停歇的融资烧钱。
目前,从适应证看,PD-1四小龙中,替雷利珠单抗以10项适应证遥遥领先。2023年年初的国家医保谈判中,除特瑞普利单抗外,其他三家PD-1产品均有新适应证被纳入。信迪利单抗的一线胃腺癌、一线食管鳞癌进入医保目录,率先成为当下将五大一线适应证全部纳入医保的PD-1产品。至此,替雷利珠单抗成为纳入医保适应证最多的产品,而特瑞普利单抗垫底,且是在非小细胞肺癌、肝细胞癌等大癌种上唯一没有医保覆盖的PD-1。
在这样的竞争格局下,特瑞普利单抗2023年以来动态频频,寻求出海也就让人不难理解了。今年3月和5月,君实生物分别宣布两起合作,在欧美地区以外寻求新兴市场。此外,公司日前披露特瑞普利单抗鼻咽癌适应证在美国食药监局(FDA)的上市申请已顺利完成生产基地的许可前检查(PLI)。这意味着该产品在美国出海的进程又向前一步。
实际上,在君实生物靠海外授权收入离盈利最近的2021年,其特瑞普利单抗(商品名:拓益)的销售收入令人大跌眼镜。这是君实生物的首款商业化产品,也是首个国产PD-1。作为一家biotech率先上市的核心产品,特瑞普利单抗或许应该在管线组合和现金流上都起到一定的基石性作用,但特瑞普利单抗在业绩上的表现难言亮眼。
界面新闻记者 | 陈杨
前者则是一种靶向PCSK9的新型降脂药,用于治疗原发性高胆固醇血症和混合型高脂血症。PCSK9抑制剂被认为为降脂提供了一种全新的治疗模式,是他汀类药物之后的重磅品种,在2021年全球创收规模为15.5亿美元。
其中,20亿用于创新药研发项目,10亿元用于补充流动资金,4亿元用于上海君实生物科技产业化基地建设项目。
fastboot是什么意思 fastboot一直开不了机
对于安卓手机而言,它的乐趣是什么?是丰富的系统功能,还是对开放系统的追求?在下结论之前,不妨看看这样一个新闻,耐心看完。最近,据XDA开发者论坛消息,三星推出的GalaxyZFold3,在解锁BootLoader后出现无法使用相机的情况。BootLoader,即为引导加载程序,简称:BL。大财经2023-03-21 03:58:330000一尺多少厘米 一寸等于多少厘米
元旦期间和家人、朋友们观看了日本漫画家宫崎骏的《千与千寻》动漫。《千与千寻》2001年7月20日在日本上映,2019年6月21日在中国正式上映。这次是我第二次看,颇有意思。“千”和“千寻”都是动漫主人公荻野千寻的名字,“千寻”是她的本名,“千”是汤婆婆给她的名字。“与”就是和的意思。0000青岛一房东的无声崩溃!
最近一个朋友把李沧的房子卖了,让我算一算他到底赔了多少钱。这是一个沉重的问题,也比较有借鉴意义,经过他的允许,我把相关数据透漏给大家。他是2019年买的这套房子,二套房,二手次新房,面积90平。之所以第二套房还买这么小的,是因为当时第一套房不舍得卖,老人孩子又住不开,手里还有点闲钱,就再买了这套房子。大财经2023-11-29 13:10:020000我国即将进入深度老龄化社会,来看详细的数据趋势分析吧
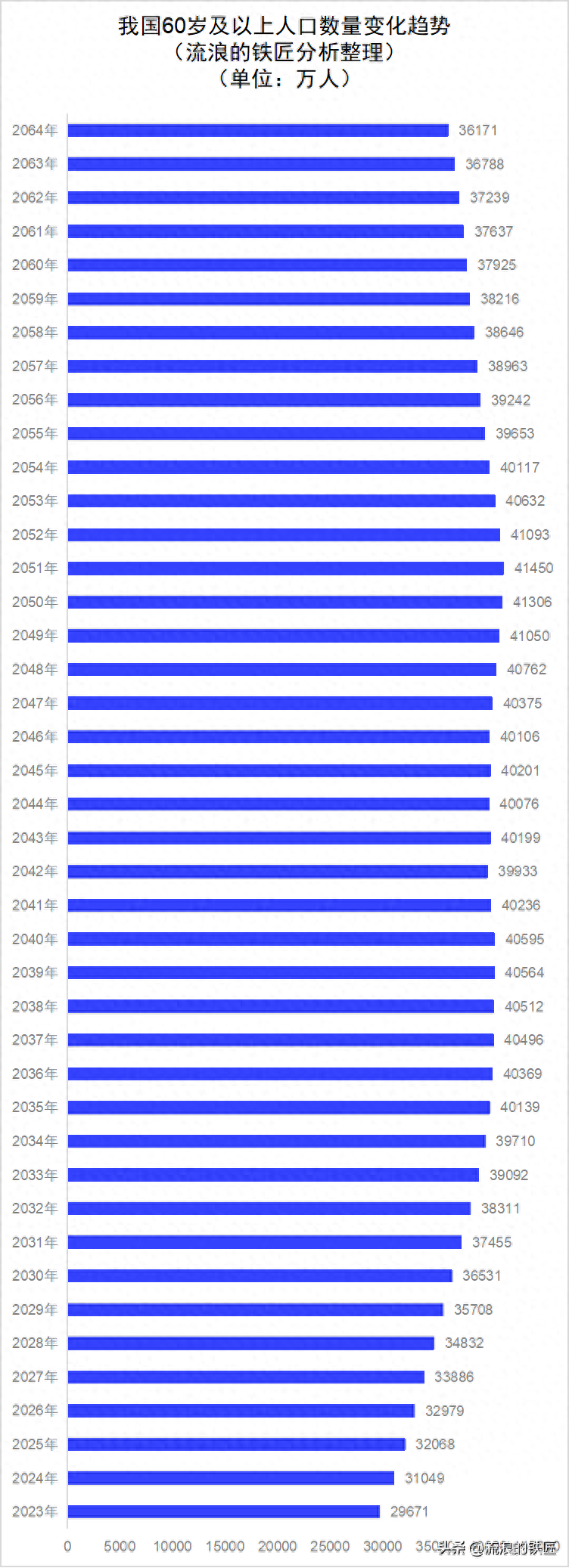
有粉丝朋友给铁匠留言,建议铁匠就我国未来的60岁及以上老龄人口数量变化和占总人口的比例出一期分析报告,让大家直观感受我国面临的老龄化形势。今天铁匠将专门探讨我国未来老龄人口的变化趋势。先来看看铁匠根据第七次人口普查基础数据预测的我国老龄人口的数量变化趋势情况大财经2023-11-13 16:29:590000身份证丢失怎么办?需要怎么做 身份证丢失后最佳做法
【问】:身份证如何挂失?【答】:居民身份证丢失、被盗的群众,可持居民户口簿到常住户口所在地公安机关申报挂失并办理补领手续。离开常住户口所在地的,可到就近的户籍派出所或户政办证大厅申报挂失。【问】:身份证丢了,现在人在外地,请问可以在外地补办吗?【答】:外地补领身份证的,需要先申请暂住证或登记过流动人口信息的才能办理。【问】:身份证到期更换,需要什么资料?0000