医疗器械分类(医疗器械分类明细)
1.与已上市产品、分类目录或分类界定通知文件中相关产品的分析及对比,并说明符合新研制尚未列入分类目录产品的判定原则;
(一)分类界定申请表。应有法定代表人或负责人签字并加盖公章,如未经市场监管局注册,应提供《企业名称预核准通知书》等其他证明性文件,并由拟定法定代表人在申请表签字并注明日期。
2.核心刊物公开发表的能够充分说明产品临床应用价值的学术论文、专著及文件综述;
(二)产品照片和/或产品结构图。
(四)申请材料左页边距一般应大于20mm(用于档案装订)。
供稿|北京市药监局医疗器械注册管理处
(五)申请材料中同一项目的填写应当一致。
(五)属于新产品的相关资料(如有),应当包括:
(二)申请人填报的表格和编写的申请材料均应为A4规格纸张,政府及其他机构出具的文件原件按原尺寸提供。
北京市医疗器械技术审评中心自接收申请材料之日起7个工作日内,完成技术审查,对申请材料不符合审查标准需要修改的,提出相应的补充修改意见,双方签字、注明日期(补充材料时间不计算在审查期限内)。对于修改补充材料后符合审查标准的,审查完毕后出具技术审查意见,填写《分类界定审批表》,将相关技术审查意见及申请材料提交至北京市药品监督管理局医疗器械注册处。
(三)凡申请材料应提交复印件的,复印件应清晰,并应在复印件上注明日期,加盖企业公章。
一、医疗器械分类界定需要提交哪些材料?
三、医疗器械分类界定工作时限是多少?
(六)所提交资料真实性的自我保证声明,并作出材料如有虚假承担法律责任的承诺。
(七)其他与产品分类界定有关的材料。
(四)使用说明。
4.信息或者专利检索机构出具的查新报告;
5.其他相关证明材料。
医疗器械产品分类界定应自接收申请材料之日起10个工作日(不含接收、寄送期限)内完成类别确认工作,需要补充资料时间不计算在内。
(一)申请材料应真实、完整、清晰、整洁,逐份加盖企业公章,要求签字的须签字。
北京市医疗器械技术审评中心对申请材料齐全、符合形式审查要求的,应当于2个工作日内网上办理接收申请材料。
市药监局医疗器械注册管理处自收到申请材料之日起3个工作日内完成分类界定的审定工作。对分类界定审查可以确定产品类别的,直接在分类界定信息系统告知申请人分类界定结果;对分类界定审查不能确定类别的,应确认预分类意见,并于2个工作日内将相关材料寄送至国家药品监督管理局医疗器械标准管理中心。
申请人通过中国食品药品检定研究院网站的“办事大厅”进入“医疗器械标准与分类管理”页面(网址:http://www.nifdc.org.cn/nifdc/),在“医疗器械分类界定信息系统”中进行网络注册,注册后填写《分类界定申请表》,并上传其他申请材料。申请人应将在线打印的《分类界定申请表》,连同其他申请材料(应与网络上传的资料完全相同)加盖申请人骑缝章,并将申请材料通过邮寄或现场方式提交至北京市医疗器械技术审评中心(地址:西城区水车胡同13号,电话:010-58549949)。
3.产品的创新内容;
二、医疗器械分类界定申请材料有哪些具体要求?
(八)申报资料时,不是法定代表人或负责人本人的,应当提交《授权委托书》。
(三)产品技术要求和编制说明。
四、如何申请医疗器械分类界定?
一克拉钻戒的价格 10克拉钻石价格表
预算5、6万元,完全已经可以入手1克拉钻戒,并且选择范围也很广,最大甚至可以买到1.5克拉的钻戒,下面是5、6万元左右的N种一克拉钻戒挑选方案!①方案1:白1克拉+E色+SI11克拉+F色+SI1在钻石颜色等级表中,EF色属于第一梯队,表示“无色”级钻石,任何角度观察都是无色透明的,视觉效果佳,尤其适合对颜色敏感的朋友;大财经2023-03-25 04:07:520000白细胞高说明什么 白细胞偏高怎么降下来
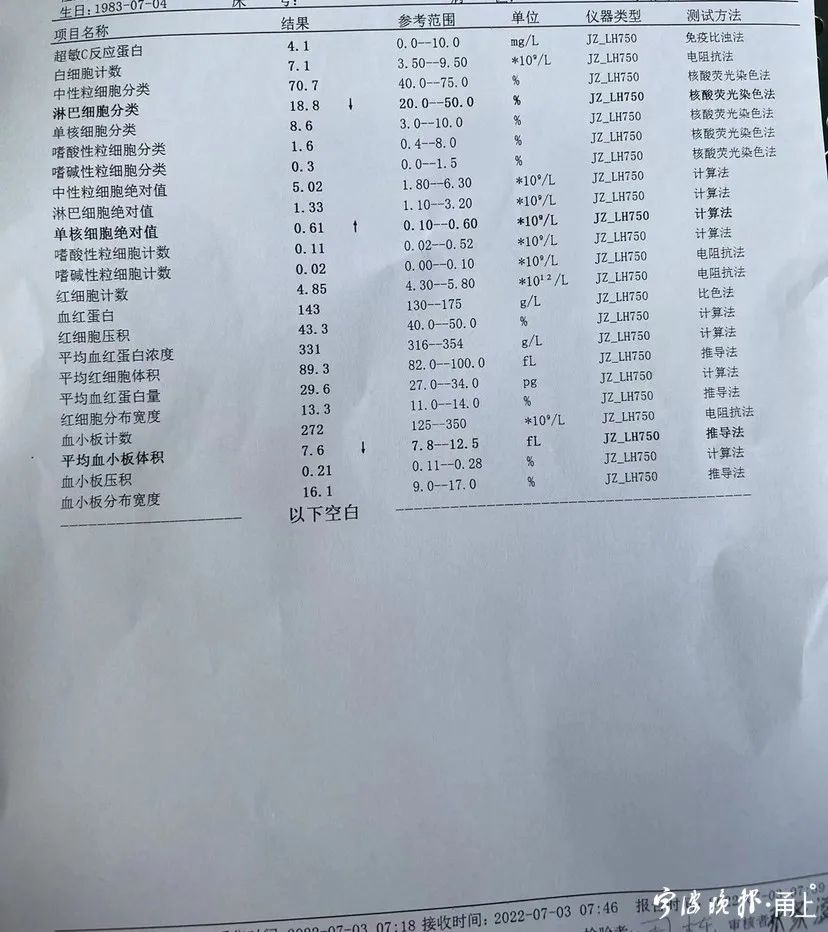
来源:宁波晚报生活号"要是前几年拿到体检报告后,我能好好重视血常规化验单里高高低低的箭头,就不会弄得现在这样了。"正在宁波市第一医院血液科住院患者黄阿姨后悔不迭。近日,她被确诊为慢性淋巴白血病。血常规是体检的必备项目,主要检查指标包括白细胞、红细胞、血小板。该院血液科主任医师盛立霞介绍,白细胞堪称人体健康卫士,市民一定要重视白细胞的相关检查数据。"只关注了白细胞总数,没看比例"大财经2023-03-13 18:40:460005眼皮跳是什么原因怎么办 眼皮跳怎么缓解小妙招
最近眼皮一直跳,同事说是左眼跳财,可是持续了1周了,要不要去医院看一下?今天妙手医生给大家讲清楚。这种眼皮跳一般发作时间较短,跳动程度不严重,毫无征兆的出现,又毫无症状的停止,就像夏天午后的雷阵雨,颇有「来无影去无踪」的感觉。医学上,它被称作「眼睑震颤」或「痉挛」,是神经或眼部肌肉受到刺激后产生的颤动。说是眼皮跳,其实是眼轮匝肌、眼睑举肌这类眼部肌肉在神经支配下发生颤动,进而带动皮肤的跳动。大财经2023-03-21 19:15:440000美媒关注北京“方舱”变公寓
近期,美国媒体聚焦在北京一项备受关注的城市转型计划——将之前用作应对突发传染病的医疗方舱,转变成为居民提供的公寓式住宅。这一举措旨在利用现有基础设施,为城市的居民提供更为便利的居住环境。这种独特的城市更新方案不仅引发了社会各界的关注,同时也引发了一系列讨论,涉及城市规划、卫生安全和社会服务等多个层面。大财经2023-12-11 17:51:100000冷库建设多少钱一平方 建100平方冷库多少钱
「链接」冷链物流是随着现代商品经济的快速发展而形成的一种新型运输方式。它是以冷冻或冷藏车(船)为主要工具的低温货物运输系统;它是制冷技术发展及相应设备、技术的应用在流通领域中的具体体现和总称。目前我国已建成并投入运营的综合型现代化食品加工企业中,有90%以上采用自动化立体仓库进行货物存放作业,以实现快速周转与高效配送的目的。大财经2023-03-22 14:06:360000