碳酸钠溶解度 60摄氏度碳酸钠溶解度
课题1溶液的酸碱性
一、 酸、碱与指示剂作用
1、酸碱指示剂(简称指示剂):能与酸或碱作用显示不同颜色的物质。
2、常见的酸碱指示剂: 紫色石蕊试液、 无色酚酞溶液
3、酸性溶液:能使紫色石蕊试液变红,不能使无色酚酞变色。(石蕊溶液本色为 紫色)
碱性溶液:能使紫色石蕊试液变蓝,能使无色酚酞变红。 (酚酞溶液本色为 无色)
中性溶液:不能使酸碱指示剂 变色
思考:要将石灰水、白醋、水三种无色液体一次鉴别出来,应选紫色石蕊试液
4、【注意事项】
①溶液分酸性、中性、碱性。
②溶液中滴入酚酞试剂,不变色,溶液可能是酸性溶液,也可能是中性溶液。
③难溶的酸碱不能使指示剂变色。如Cu(OH)2、Fe(OH)3、Al(OH)3 等不能使指示剂变 色,因为它们难溶于水
④指示剂遇到酸溶液和碱溶液时,变色的是指示剂,而不是酸溶液和碱溶液。
⑤根据指示剂颜色的变化,只能判断溶液的 酸碱性,不能确定此溶液一定是酸或一定是碱。
5、 常见的酸性溶液:酸(如:盐酸、硫酸、硝酸、碳酸、醋酸)和部分盐溶液(如:CuSO4溶液)
常见的碱性溶液:可溶性碱(如:KOH溶液、NaOH溶液,氨水NH4 OH 、Ba(OH)2溶液、Ca(OH)2溶液)
部分盐溶液(如:碳酸钠溶液(Na2CO3),碳酸氢钠NaHCO3)
常见中性溶液:糖水,食盐水
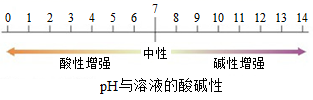
二、溶液酸碱性的表示方法—pH值
1、溶液的酸碱性用酸碱指示剂测定。 溶液的酸碱度用pH试纸测定。
2、PH的范围:0~14
3、PH<7,溶液显酸性,pH越小,酸性越强。 酸性溶液不一定是酸的溶液。如:CuSO4
PH=7,溶液显中性
PH>7,溶液显碱性,pH越大,碱性越强。碱性溶液不一定是碱的溶液。如:碳酸钠溶液显碱性,但碳酸钠不是碱,是盐。
4、PH的测定方法:用玻璃棒蘸待测液滴在pH试纸上,把试纸显示的颜色与标准比色卡比较,得出溶液的pH值
5、PH的测定操作时常见错误:
①不要将试纸伸入待测液中;后果:污染待测液
②不能将试纸先用水润湿; 后果:酸性溶液PH偏大;碱性溶液PH偏小;中性溶液PH不变
6、.PH与溶液酸碱性的关
7、注意: PH试纸所测PH只能为整数(要得到精确值用:精密PH试纸或PH计)
三、了解溶液的酸碱度的意义
1、正常雨水的pH为5.6 原因:CO2+H20==H2CO3
酸雨的pH<5.6原因:SO2+H20==H2SO3
2、肥皂水、洗洁精、草木灰水(K2CO3)、纯碱溶液均为碱性,PH>7
四、溶液稀释后PH的变化
①酸溶液加水稀释(如图1) ②碱溶液加水稀释(如图2)
酸性减弱,PH值无限接近7 碱性减弱,PH值无限接近7。
但不会等于或大于7 但不会等于或小于7
课题2常见的酸和碱
五:酸、碱和盐概念
(1) 酸(酸←氢离子+酸根离子)
酸:酸由氢离子和酸根离子构成;其特点是溶液中阳离子都是氢离子
如:盐酸HCl、硫酸H2SO4、硝酸HNO3、碳酸H2CO3、醋酸 CH3COOH 磷酸H3PO4等。组成上都含有氢 元素
(2)碱(碱←金属离子+OH-)
碱:碱由金属(或铵根)离子和氢氧根离子构成;其特点是溶液中的阴离子都是OH-离子
碱类物质在命名上是 氢氧化某 ,从组成上看都含有 氢、氧 元素。
如氢氧化钠NaOH、氢氧化钙Ca(OH)2、 氨水NH3·H2O、 氢氧化钾KOH、氢氧化钡Ba(OH)2 、氢氧化铜Cu(OH)2、氢氧化铁Fe(OH)3、 氢氧化亚铁Fe(OH)2 、 氢氧化镁Mg(OH)2氢氧化铝Al(OH)3
(3)盐(盐←金属离子+酸根离子)
盐:是由 金属(或铵根)离子 和 酸根离子 构成的化合物;
命名为“ 某化某 ”或“ 某酸某 ”。
如:氯化钠 NaCl 、碳酸钠Na2CO3、碳酸氢钠NaHCO3、碳酸钙CaCO3、高锰酸钾 KMnO4 、亚硝酸钠 NaNO2等;
六、常见的酸
1、盐酸 (HCl气体的水溶液。)
物理性质:①无色液体②有刺激性气味③有挥发性
用 途:①除铁锈②帮助消化(胃酸) ③制药物
注 意: ①浓盐酸在空气中产生白雾的原因:浓盐酸挥发出的HCl气体与空气中的水蒸气结合形成了盐酸小液滴。
②浓盐酸敞放在空气中,溶质的质量分数减小(密闭保存)
2、硫酸:H2SO4
物理性质:无色、油状液体。
. 用 途:①除铁锈 ②作气体干燥剂
注 意:敞口质量增加,溶质质量分数减小,应密闭保存
特 性:
①吸 水 性(物理性质):可作气体干燥剂,但不能干燥氨气(NH3)
②脱 水 性(化学性质):滴在纸上,蔗糖上使其变黑
③强氧化性(化学性质):不能用浓硫酸制H2。虽然浓硫酸能与金属反应,但不产生H2。
稀 释 浓 硫 酸 的 方 法 :将浓硫酸沿器壁慢慢注入水中,并不断搅拌。
玻 璃 棒 的 作 用 :搅拌,使产生的热量迅速扩散。
浓硫酸沾在皮肤上的处理方法.:先用大量的水冲洗,在涂3%--5%的NaHCO3溶液
3、酸的化学性质
① 与指示剂作用:能使紫色石蕊变红,不能使无色酚酞变色。
② 酸 + 活泼金属 → 盐 + H2↑ (置换反应)
条件:金属要比氢活泼,酸为稀硫酸或盐酸。
③ 酸+金属氧化物→盐+ H2O (复分解反应)
CuO+2HCl==CuCl2+H2O
Fe2O3+6HCl==2FeCl3+3H2O
CuO+H2SO4==CuSO4+H2O
Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
④ 酸+碱→盐+ H2O (复分解反应)
NaOH + HCl==NaCl+H2O
Cu(OH)2 + 2HCl==CuCl2 + 2H2O
Fe(OH)3 + 3HCl==FeCl3 + 3H2O
⑤ 酸+盐→新的酸+新的盐(复分解反应)
HCl+AgNO3==AgCl↓+HNO3
CaCO3+2HCl==CaCl2+H2O+CO2↑
NaHCO3+HCl==NaCl+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
七、常见的碱: 氢氧化钠:NaOH 氢氧化钙:Ca(OH)2 、氢氧化钾:KOH 、氢氧化钡:Ba(OH)2
氢氧化铜:Cu(OH)2 、氢氧化铁:Fe(OH)3 、氢氧化镁:Mg(OH)2、氢氧化铝:Al(OH)3
氨水:NH3. H2O
1、氢氧化钠:
俗 名:火碱、烧碱、苛性钠。
物理性质:易溶于水且放热(有吸水性,NaOH固体可作某些气体的干燥剂,但不能干燥CO2、SO2、HCl)
用 途:做干燥剂、去除油污、制肥皂。
注 意:①NaOH固体要密封保存的原因:a:防止吸收空气中的水分而潮解;
b:防止吸收空气中的CO2而变质。
(反应方程式:2NaOH+CO2==Na2CO3+H2O)
②检验NaOH是否变质的方法:加入稀盐酸,若有气泡,则变质。
(反应方程式:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑)
■探究氢氧化钠溶液变质情况:假设1:没有变质。假设2:部分变质。假设3:全部变质。
具体方法步骤:
(1)取溶液少许,滴加稀盐酸,若没有气泡,则没有变质,假设1成立。若有气泡,则已变质。
(2)取变质的溶液,先加足量的BaCl2或CaCl2溶液,再滴加无色酚酞溶液,若溶液变红,则部分变质,假设2成立,若不变色,则假设3成立。
发生反应的化学方程式:
Na2CO3 +CaCl2 == 2NaCl + CaCO3↓
或Na2CO3 +BaCl2 == 2NaCl + CaCO3↓
2、氢氧化钙Ca(OH)2:
俗 名:熟石灰、消石灰
物理性质:微溶于水。溶解度随温度的升高而减小。
用 途:建筑材料。 农业上用来改良酸性土壤。林业上用来防虫害
制 取:CaO+H2O=Ca(OH)2
石灰浆抹墙后变硬的原因:Ca(OH)2+CO2==CaCO3↓+H2O
3、碱的通性
① 与指示剂作用:可溶性碱溶液能使石蕊变蓝,酚酞变红。
② 碱+金属氧化物→盐+ H2O (不是复分解反应)
条件:碱必须微溶或可溶
Ca(OH)2+CO2==CaCO3↓+H2O
2NaOH+CO2==Na2CO3+H2O
2NaOH+SO2==Na2SO3+H2O
2NaOH+SO3==Na2SO4+H2O
③ 碱+酸→盐+H2O (复分解反应)
NaOH+HCl==NaCl+H2O
2NaOH+H2SO4==Na2SO4+2H2O
Cu(OH)2+2HCl==CuCl2+2H2O
Cu(OH)2 +H2SO4==CuSO4 +2H2O
现象: 蓝色沉淀逐渐消失,溶液由无色变为蓝色
Fe(OH)3+3HCl==FeCl3+3H2O
2Fe(OH)3+H2SO4==Fe2(SO4)3+3H2O
现象: 红褐色沉淀逐渐消失,溶液由无色变为黄色
Fe(OH)2+2HCl==FeCl2+2H2O
Fe(OH)2++H2SO4==FeSO4+2H2O
现象: 白色沉淀逐渐消失,溶液由无色变为浅绿色色
④ 碱+盐→新的碱+新的盐 (复分解反应)
反应的条件:反应物碱和盐都可溶,同时符合复分解反应条件
3NaOH+FeCl3=Fe(OH)3↓+3NaCl
2NaOH+CuCl2=Cu(OH)2↓+2NaCl
八、酸、碱具有通性的原因
1、酸具有相似化学性质的原因:不同的酸在水溶液中都能解离出H+
碱具有相似化学性质的原因:不同的碱在水溶液中都能解离出OH-
九、中和反应
1、教材P48 活动与探究实验中要注意以下几点:
① 酚酞的作用:通过溶液颜色的变化确定中和反应是否完成
② 慢慢滴入盐酸的目的:防止盐酸过量
③ 不断搅拌溶液的目的:使盐酸与NaOH 充分反应
④ 恰好完全反应的标志:溶液由红色变为无色
2、中和反应:酸与碱生成盐和水的反应。
NaOH+HCl==NaCl+H2O
注 意:①中和反应是复分解反应,但复分解反应不一定是中和反应。
在提到基本反应类型时,不能说成中和反应,必须说复分解反应。
②中和反应要生成盐和水,但生成盐和水的反应却不一定是中和反应。
③中和反应的实质是酸的H+和碱OH-的结合成H2O;中和反应都要放热。
H+ +OH- = H2O
十、中和反应在实际中的应用
1、改良土壤的酸碱性。如:用熟石灰改良酸性土壤。
2、处理工厂污水:Ca(OH)2+H2SO4==CaSO4+2H2O
3、用于医药:蚊虫叮咬肿痛可涂碱性物质 ; 用含_碱性_物质的药物中和过多的胃酸
如用氢氧化铝治疗胃酸过多:Al(OH)3+3HCl== AlCl3+3H2O
十一、复分解反应
1、概念:两种化合物相互交换成分,生成两种新的化合物的反应。
特 点 :双交换,价不变
表达式:AB+CD==AD+CB
2、复分解反应的条件:生成物中有沉淀、气体或水生成。
常见的沉淀有:Mg(OH)2、Al(OH)3、Fe(OH)3、Cu(OH)2、 AgCl、BaCO3、CaCO3、BaSO4
常见的气体有:CO2、NH3 、CO 、H2
3、复分解反应的范围:酸、碱、盐、氧化物之间的反应,除碱与非金属氧化物的反应外,其余均为复分解反应。
① 酸+碱→盐+ H2O 如:NaOH +HCl==NaCl+H2O
② 酸+盐→酸+盐 如:HCl+AgNO3==AgCl↓+HNO3
③ 酸+金属氧化物→盐+ H2O 如:Fe2O3+6HCl==2FeCl3+3H2O
④ 碱+盐→碱+盐 如:3NaOH +FeCl3 ==Fe(OH)3↓+3NaCl:
⑤ 盐+盐→盐+盐 如:BaCl2+Na2SO4==BaSO4↓+2NaCl
其中④、⑤两类物质间的反应条件,除了要满足复分解反应的条件外,另外,反应物还必须可溶。
4、教材P127溶解性表中要掌握的内容
(1)钾盐、钠盐、铵盐、硝酸盐全溶
(2)难溶碱:Mg(OH)2、Al(OH)3、Fe(OH)3、Cu(OH)2、氢氧化钙微溶
难溶盐:AgCl、BaCO3、CaCO3、BaSO4
(3)其中既不溶于水,也不溶于酸的↓:AgCl与BaSO4。
(4)沉淀颜色:Cu(OH)2蓝色、Fe(OH)3红褐色,其余均为白色。
离子颜色:Cu2+蓝色、Fe3+黄色、Fe2+ 浅绿色、MnO4- 紫色
课题3、几种重要的盐
十二、常见的盐
1、NaCl 俗名:食盐 ,白色晶体、显中性,易溶于水。
用途:调味品、制生理盐水、氯化钠溶液选种、防腐剂(腌渍蔬菜)、融雪剂
误食工业用盐会引起人体中毒,主要因为工业用盐的成分为亚硝酸钠(NaNO2)
2、Na2CO3、CaCO3、NaHCO3
(1)Na2CO3俗名:纯碱、苏打白色粉末、显碱性,易溶于水
用途:制玻璃、造纸、纺织、洗涤剂
(2)CaCO3白色固体,不溶于水 ;石灰石、大理石、蛋壳、水垢的主要成分。
用途:建筑材料、补钙剂
(3)NaHCO3 俗名:小苏打白色粉末、显碱性,易溶于水
用途:焙制糕点的发酵粉、治疗胃酸过多
3、常见盐的化学性质
(1)NaCl能与AgNO3 反应生成白色沉淀
化学方程式:AgNO3+NaCl==AgCl↓+NaNO3
该反应用于检验:氯离子 的存在
(2)碳酸盐的化学性质
与酸反应
Na2CO3+2HCl==2NaCl+H2O+CO2↑
NaHCO3+HCl==NaCl+H2O+CO2↑
CaCO3+2HCl==CaCl2+H2O+CO2↑
■ 碳酸盐的检验:取被检验的物质少量,加入稀盐酸,若有气泡产生,且该气体能使澄清石灰水变浑浊,则为碳酸盐。
与碱的反应
Na2CO3 +Ca(OH)2 = 2NaOH + CaCO3↓
■(该反应用于除去NaOH中杂质Na2CO3、或用于除去NaOH中杂质Ca(OH)2)
4、碳酸盐受热分解
CaCO3 高温下分解 NaHCO3 受热易分解
CaCO3 ==高温==CaO +CO2↑
2NaHCO3 ==加热==Na2CO3+H2O +CO2↑
5、补充化学方程式:
① 碳酸钙能溶于含有二氧化碳的水: CaCO3 +H2O +CO2 == Ca(HCO3)2
② 碳酸氢钙受热分解:Ca(HCO3)2 ==加热==CaCO3↓ +H2O +CO2↑
6、盐的通性
① 盐+金属→新盐+新金属
Fe+CuSO4=FeSO4+Cu ;
Zn + CuSO4==ZnSO4 + Cu
② 盐+酸→新盐+新酸
CaCO3+2HCl==CaCl2+H2O+CO2↑;
H2SO4+BaCl2==BaSO4↓+2HCl ;
③ 盐+碱→新盐+新碱
2NaOH+MgCl2==Mg(OH)2+2NaCl ;
Ba(OH)2+Na2SO4==BaSO4↓+ NaOH;
④ 盐+盐→两种新盐
Na2SO4+BaCl2=2NaCl+BaSO4↓;
Na2CO3+CaCl2=2NaCl+CaCO3↓;
十三、 粗盐的提纯:(粗盐中含有泥沙等难溶性杂质和MgCl2和CaCl2等可溶杂质)
步 骤: ①溶解 ② 过滤 ③ 蒸发结晶 ④转移称量,计算产率
注 意:溶解、过滤只能除去难溶性杂质,不能除去可溶性杂质。
玻璃棒的作用:溶解时,搅拌,加速溶解。
过滤时,引流。
蒸发时,不断搅拌,防止液体飞溅,出现较多固体时,停止加热,利用余热蒸干。
除去可溶性杂质MgCl2和CaCl2分别用NaOH和Na2CO3,
对应反应方程式为:
MgCl2+2NaOH=2NaCl+Mg(OH)2↓
CaCl2+ Na2CO3 = 2NaCl + CaCO3↓
十四、化肥简介
1、氮肥
① 作用:促进作物的茎叶生长,叶色浓绿。
② 常见氮肥:尿素:CO(NH2)2:含氮量最高,且为有机物 ,不含铵根,不与碱作用产生氨气。
氨水:NH3.H2O:易挥发、是碱,
碳酸氢铵:NH4HCO3 ,氯化铵:NH4Cl ,
硝酸铵:NH4NO3,硝酸钠:NaNO3
③ 注意:铵态氮肥不能与碱性物质混合使用,否则铵盐与碱反应放出氨气,失去肥效。
如:2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑+2H2O
检验铵根离子的方法是:,加入浓氢氧化钠溶液,加热
2、磷肥
① 作用:促进作物根系生长,增强抗寒、抗旱能力。
② 常见磷肥:磷矿粉:Ca3(PO4)2、钙镁磷肥、过磷酸钙<Ca(H2PO4)2 与CaSO4的混合物>。
3、钾肥
① 作用:促进作物茎生长,增强抗病虫害、抗倒伏的能力。
② 常见钾肥:K2SO4、KCl 、草木灰(主要含有K2CO3)
4、复合肥:同时含有N、P、K中两种或多种营养元素的化合物。
常见复合肥: KNO3 、NH4H2PO4 、(NH4)4HPO4、KH2PO4
5、化肥作用口诀:氮磷钾、一根筋
十五、化肥的合理使用:
1、利:提高作物的产量。
2、弊:不合理使用会造成土壤污染、土壤退化、水污染、大气污染。
3、化肥与农家肥混合使用效果更好。
4、水中磷元素过多造成水体富营养化——水藻疯长— 海洋中:赤潮 淡水中:水华
十六、化肥的简易鉴别
1、看外观:氮肥、钾肥为白色晶体,磷肥为灰白色粉末。
2、加水:氮肥、钾肥易溶,磷肥不溶或部分溶。
3、加熟石灰:铵态氮肥有刺激性的放出,而其它氮肥、磷肥、钾肥则无此现象。
4、几种氮肥:CO(NH)2、NH4NO3、NH4Cl、(NH4)2SO4的鉴别方法。
方法: ①各取样品少量,分别加入Ca(OH)2粉末,研磨,无刺激性气味的是CO(NH)2;
②另取其余三种化肥少量分别加入少量Ba(NO3)2溶液,有白色沉淀的是(NH4)2 SO4,
③再取剩余两种化肥少量,分别加入AgNO3溶液,有白色沉淀的是NH4Cl 。
示波器的使用方法 示波器新手入门教程
示波器作为工程师几乎天天使用的得力工具,其重要性毋庸置疑。尤其随着新器件应用,新技术的发展,新标准的推出工程师面临着更加复杂的信号设计及验证的要求。在本教程中,泰克公司的资深的技术工程师为你进行示波器的使用大揭秘,真正的理解示波器的主要指标对测试的影响,并使用泰克最新的MSO5系列混合信号示波器实际演示在debug各个阶段如何提高调试效率,提高测试精度。观看教程请点击“了解更多”了解更多大财经2023-03-23 03:19:42000133年的接班人培养计划,却迎来英国投资失利,李嘉诚选对了吗?
#5月财经新势力#视频请点击下方链接:李嘉诚英国生意,要被儿子卖了?太子投资失利,接班人选对了吗?大财经2023-05-22 12:34:480001美国签证状态查询 申请美国签证状态查询
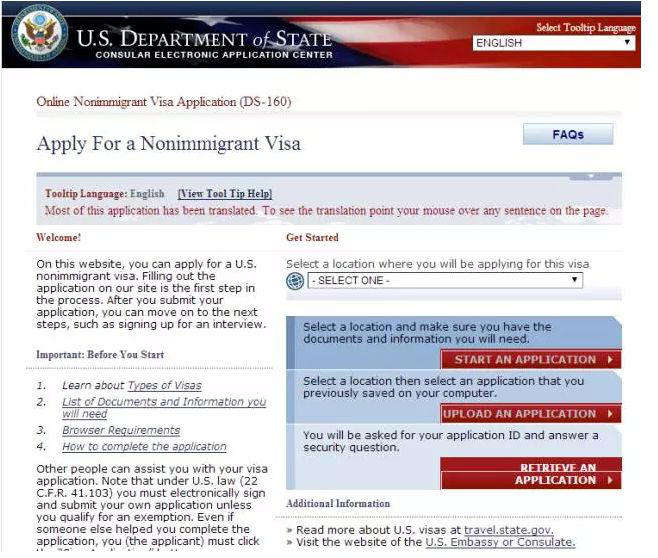
在进行美国签证的申请中,面签的时候我们基本都可以知道自己的签证是否通过,但是我们是不能直接拿到签证的。不管你申请的是哪类签证,都需要不同时间的等待,如果被行政审核的,会需要更长的时间来等待。在等待的这个过程中,很多人可能非常的焦急,不仅是没看到签证心不安,主要是没有签证,这样就导致下面的行程安排会受到影响。今天美签之家咨询有限公司就为大家来科普一下最常用的如何查询签证状态。一、网站查询大财经2023-03-25 08:42:360002word下划线怎么打 word下划线怎么输入
搜索创作挑战赛最近发现许多人在使用office办公软件时,对它的功能不太了解,方便大家提升工作效率,在后面几次更新中,分享整理一些快捷键以及实用的使用技巧。今天先来分享制作完美下划线的过程!首先在文档中插入所需的表格,行数根据所需数量设置,列数2列即可。再将文本Ctrl+X,Ctrl+V剪切到表格中,并完成两列大小调整,全选表格进行居中设置。全选表格,选择边框线中的无边框。大财经2023-03-24 00:51:130000上年度冠军基又保不住了?成也偏科,败也偏科,如何保卫排名?
曾经的业绩冠军,经过一波行情的洗礼,往往会跌落神坛,能逃脱“冠军魔咒”的基金经理特别稀有。历史上冠军基金们在次年通常表现平淡,也被视为行业里打不破的“魔咒”,而今年似乎尤其如此。大财经2023-05-08 23:16:430000